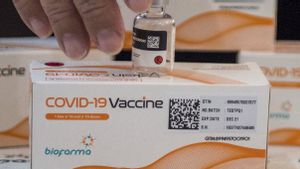
JAKARTA - Badan Pengawas Obat dan Makanan (BPOM) menerbitkan izin kedaruratan atau emergency use authorization (EUA) kepada PT Bio Farma untuk memproduksi vaksin untuk COVID-19.
Hal ini dikatakan oleh Kepala BPOM Penny K. Lukito dalam acara penandatanganan izin kedaruratan kepada PT Bio Farma.
"Emergency use authotization untuk vaksin yang diproduksi oleh PT Biofarma, pada hari ini bisa disetujui. Vaksin produksi PT Biofarma ini diberi nama 'Vaksin COVID-19'," kata Penny dalam konferensi pers virtual, Selasa, 16 Februari.
Dalam proses produksi vaksin yang baru diizinkan ini, PT Bio Farma melakukan kerja sama transfer teknologi dari perusahaan produsen vaksin asal China, Sinovac.
BACA JUGA:
Bio Farma mendapat bahan baku berupa bulk vaksin dari Sinovac. Bulk ini akan diproses produksi oleh Bio Farma. Kedatangan dari importasi bulk vaksin dari sinovac ini telah diakukan sebanyak 2 kali, yaitu 15 juta dosis pada tanggal 12 Januari, dan 11 juta dosis pada tanggal 2 Februari 2021.
Walaupun Vaksin COVID-19 yang di produksi di PT Biofarma sama kandungan dan profil, mutu, khasiat, keamanannya, dengan vaksin CoronaVac yang diproduksi Sinovac, penerbitan izin kedaruratannya tetap dilakukan kembali.
"Ini membutuhkan pengujian dan evaluasi khusus dan pemberian EUA yang terpisah dengan vaksin CoronaVac karena adanya perbedaan tempat produksi dan perbedaan kemasan. Maka, perlu diregistrasikan kembali sebelum dapatkan persetujuan penggunaan," ujar Penny.
Vaksin ini mempunyai bentuk sediaan file 5 mili. Vaksin ini berisi 10 dosis vaksin per file yang merupakan vaksin dari virus yang diinaktivasi. Dikemas dalam dus berisi 10 file, stabil disimpan pada suhu 2 sampai 8 derajat Celcius.
"Setiap file dilengkapi dengan dua dimensi barcode, yang menunjukkan identitas masing-masing file dan berfungsi untuk melakukan tracking dan mencegah pemalsuan vaksin," imbuhnya.