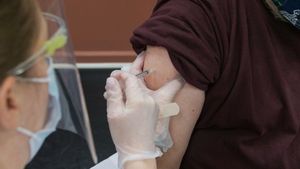
JAKARTA - Proses persiapan vaksinasi COVID-19 yang diawali dengan vaksin merek Sinovac sempat diwarnai kehawatiran beberapa waktu lalu. Sebanyak 3 juta Vaksin Sinovac telah didistribusi ke seluruh provinsi.
Banyak daerah yang menentukan tanggal memulai vaksinasi, hingga rencana Presiden Joko Widodo (Jokowi) menjadi orang pertama disuntik pada 13 Januari mendatang.
Padahal, saat rencana itu dilontarkan dan vaksin didistribusikan, izin kedaruratan atau emergency use authorization (EUA) belum dikeluarkan oleh Badan Pengawas Obat dan Makanan (BOPM).
Sampai akhirnya, BPOM Penny K. Lukito memastikan EUA akan keluar sebelum target pemerintah memulai vaksinasi pada 13 Januari mendatang.
"Tentang kepastian pemberian EUA, memang sudah direncanakan pemerintah untuk tanggal 13 Januari akan melakukan vaksinasi. Kami cukup ada keyakinan akan mengeluarkan EUA sebelum tanggal tersebut," kata Penny pada Jumat, 8 Januari.
BACA JUGA:
Meski tanggal dimulainya vaksinasi sudah ditentukan oleh pemerintah, Penny mengklaim bukan berarti BPOM terdesak diharuskan memberikan EUA sebelum tanggal 13 Januari.
Penny mengatakan, kepercayaan diri BPOM mengeluarkan izin kedaruratan vaksin Sinovac sebelum 13 Januari dilandaskan pada keyakinan dan aspek keamanan.
Kata dia, hasil efikasi atau kemampuan untuk memberikan manfaat bagi orang yang menjalani uji klinis penyuntikkan vaksin sebagai dasar pemberian izin kedaruratan akan disampaikan dalam waktu dekat.
"Untuk penentuan efikasi di Indonesia akan kita sampaikan secara lengkap, pada saat nanti kami mengeluarkan EUA. Ini dikaitkan dengan statistik (hasil efikasi) di Brazil dan Turki. Jadi, kami tidak ada keraguan dikaitkan dengan metode statistik dan metode uji klinis yang sudah dilakukan di Bandung," jelasnya.
Vaksin Sinovac halal
Komisi Fatwa Majelis Ulama Indonesia (MUI) menyelesaikan sidang fatwa terkait produk vaksin COVID-19 merek Sinovac. Dalam hasil sidang pleno Komisi Fatwa beserta auditor Lembaga Pengkajian Pangan Obat-obatan dan Kosmetika (LPPOM) MUI, dinyatakan vaksin COVID-19 produksi Sinovac halal dan suci untuk disuntikkan kepada masyarakat.
"Setelah dilakukan diskusi panjang penjelasan auditor, rapat Komisi Fatwa menyepekati bahwa vaksin COVID-19 yang diproduksi Sinovac Lifescience yang sertifikasinya diajukan Bio Farma suci dan halal," tutur Ketua MUI Bidang Fatwa, Asrorun Niam Sholeh.
Menurut Asrorun, mengenai kebolehan penggunaannya, hal itu sangat terkait dengan pemutusan mengenai aspek keamanan (safety), kualitas (quality), dan kemanjuran atua efikasi (efficacy) dari Badan Pengawas Obat dan Makanan (BPOM).
Dengan demikian, fatwa resmi Majelis Ulama Indonesia terkait dengan produk vaksin dari Sinovac China ini akan menunggu hasil final dari Badan POM.
"Fatwa utuhnya akan disampaikan setelah BPOM menyampaikan mengenai aspek keamanan untuk digunakan, apakah aman atau tidak, maka fatwa akan melihat," ujarnya.
Mengenal izin kedaruratan
Izin kedaruratan atau emergency use authorization (EUA) adalah izin yang digunakan untuk metode medis tertentu dengan catatan diberikan dalam keadaan darurat.
Pihak yang berwenang menerbitkan izin kedaruratan adalah BPOM dengan didukung bukti keamanan, khasiat dan mutu yang memadai. Setelah pemberian EUA harus dilakukan pemantauan yang ketat terhadap khasiat dan keamanan jangka panjang.
Syarat pemberian izin kedaruratan vaksin Sinovac yakni vaksin harus sudah memiliki data uji klinik fase 1 dan uji klinik fase 2 secara lengkap serta data analisis interim uji klinik fase 3 untuk menunjukkan khasiat dan keamanan vaksin.
Khasiat vaksin ditunjukkan berdasarkan data efikasi vaksin, yang diukur berdasarkan persentase penurunan angka kejadian penyakit pada kelompok orang yang menerima vaksin dibandingkan dengan kelompok orang yang menerima plasebo pada uji klinis fase 3 dengan pemantauan hingga 6 bulan. WHO mempersyaratkan minimal efikasi vaksin COVID-19 adalah 50 persen dari data interim analisis 3 bulan.
Sementara, keamanan vaksin dapat diperoleh dari data uji praklinis pada hewan dan uji klinis fase 1 pada manusia. Jika telah dinyatakan aman, maka dapat dilanjutkan ke uji klinis fase 2 dan 3. Data keamanan dipantau sampai 6 bulan paska penyuntikan vaksin.
BPOM menerapkan rolling submission dalam percepatan evaluasi untuk menerbitkan izin kedaruratan. Evaluasi data sudah dilakukan sejak bulan Oktober 2020 dan per hari ini intensif dilakukan rapat evaluasi bersama tim Komnas Penilai Obat terhadap data-data yang sudah didapatkan dengan lengkap.
Saat ini Badan POM telah memasuki tahap akhir evaluasi hasil uji klinis. Ada tiga lokasi uji klinis yang dipantau BPOM, yakni negara Brazil, Turki, dan Bandung dengan pelaksana PT Bio Farma bersama Universitas Padjajaran.
Uji klinis di Brazil memberikan efikasi vaksin sebesar 78% dan di Turki 91,25%. Perbedaan efikasi antar uji klinik vaksin yang berbeda-beda di setiap negara dipengaruhi antara lain oleh faktor perbedaan jumlah subjek, pemilihan populasi subjek, karakteristik subjek, dan kondisi lingkungan.
Namun, walaupun ada perbedaan nilai efikasi, BPOM tak mempermasalahkan karena regulasi persyaratan dari WHO adalah lebih besar dari 50 persen terpenuhi.