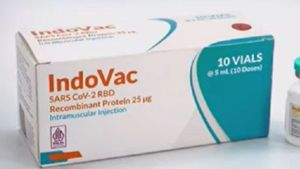
JAKARTA - PT Bio Farma (Persero) telah mendapatkan persetujuan Emergency Use Authorization (EUA) atau izin penggunaan darurat dari Badan Pengawas Obat dan Makanan (BPOM) terkait penggunaan vaksin IndoVac sebagai vaksin lanjutan atau penguat (Booster) bagi usia 18 tahun ke atas.
Persetujuan Emergency Use Authorization (EUA) atau izin penggunaan darurat tersebut didapatkan usai BPOM menerbitkan surat tanggal 21 April 2023 perihal perubahan obat INDOVAC.
Direktur Utama Bio Farma, Honesti Basyir menyampaikan bahwa dengan didapatkannya EUA dari BPOM ini, menambah daftar penggunaan vaksin IndoVac sebagai booster untuk usia 18 tahun keatas.
Kata Honesti, sebelumnya Bio Farma telah mendapatkan EUA vaksin IndoVac sebagai booster bagi masyarakat usia 18 tahun keatas yang telah menerima vaksin primer dari Sinovac dan Astra Zeneca. Teranyar, Bio Farma baru saja berhasil mendapatkan EUA vaksin IndoVac untuk booster vaksin primer COVID-19 dari Pfizer.
“Ini membuktikan bahwa vaksin IndoVac, hasil karya anak bangsa memiliki kualitas yang sejajar dengan produk global,” ujar Honesti dalam keterangan resmi, Selasa, 2 Mei.
Honesti mengatakan IndoVac tidak hanya memenuhi unsur safety, quality dan efficacy namun memiliki nilai lebih yaitu telah resmi memperoleh Fatwa dan Ketetapan Halal dari MUI yang kemudian mengantongi sertifikat halal dari Badan Penyelenggara Jaminan Produk Halal (BPJPH).
“Sehingga produknya bisa diterima seluruh penduduk dunia. Sertifikasi Halal menjadi salah satu keunggulan IndoVac dipasar global,” ucapnya.
Honesti mengatakan hasil Uji Klinis Booster Heterolog Primer Sinovac, AztraZeneca dan Pfizer menyatakan baksin aman. Kejadian ikutan pasca imunisasi (KIPI) terbanyak yaitu nyeri di tempat suntikan dan nyeri otot yang bersifat ringan.
Vaksin IndoVac sebagai dosis booster heterolog terhadap vaksin Primer (Sinovac, AztraZeneca dan Pfizer) dapat meningkatkan titer antibodi dan titer netralisasi terhadap varian Omicron. Terdapat peningkatan titer antibodi signifikan setelah dosis booster dibandingkan baseline.
“Berdasarkan data uji klinis booster IndoVac, dapat disimpulkan bahwa vaksin IndoVac memiliki profil imunogenisitas dan keamanan yang baik sebagai dosis booster peserta yang sebelumnya menerima dosis primer vaksin Sinovac, AstraZeneca, dan Pfizer,” jelasnya.
Honesti mengatakan pandemi COVID-19 masih belum berakhir, berdasarkan data dari situs covid19.go.id, per 1 Mei 2023 masih terdapat kasus aktif COVID-19 sebanyak 13.880.
BACA JUGA:
Masyarakat, sambung dia, masih harus tetap waspada dengan menjaga prokes dan vaksinasi, khususnya vaksin booster yang berdasarkan data Kementerian Kesehatan masih relatif banyak warga belum vaksinasi booster.
“Bio Farma terus mendukung upaya pemerintah dalam memperkuat infrastruktur kesehatan, salah satunya melalui program vaksinasi booster produksi dalam negeri, yaitu IndoVac,” katanya.
IndoVac merupakan Vaksin COVID-19 berbasis teknologi subunit rekombinan protein yang digunakan sebagai imunisasi aktif terhadap COVID-19 yang disebabkan oleh virus SARS-CoV-2. IndoVac juga telah memperoleh fatwa halal dan MUI dan sertifikat halal dari BPJPH, Kementerian Agama dan merupakan produk dalam negeri hasil karya anak bangsa dengan tingkat kandungan dalam negeri (TKDN) mencapai 89,84 persen.