雅加达 - 药物和食品控制局 (BPOM) 已为 PT Bio Farma 生产的 COVID-19 疫苗签发了紧急使用许可 (EUA) 或紧急使用许可证。
这是欧盟国际药品监督管理局继一段时间之后第二次为一家中国制药公司S sinovac制造的成品疫苗颁发类似的许可证。
药品和食品控制局负责人佩妮·卢基托说,欧盟疫苗管理局的发布是支持政府加速实施国家疫苗接种计划。她说,到目前为止,印尼的疫苗接种工作进展顺利。
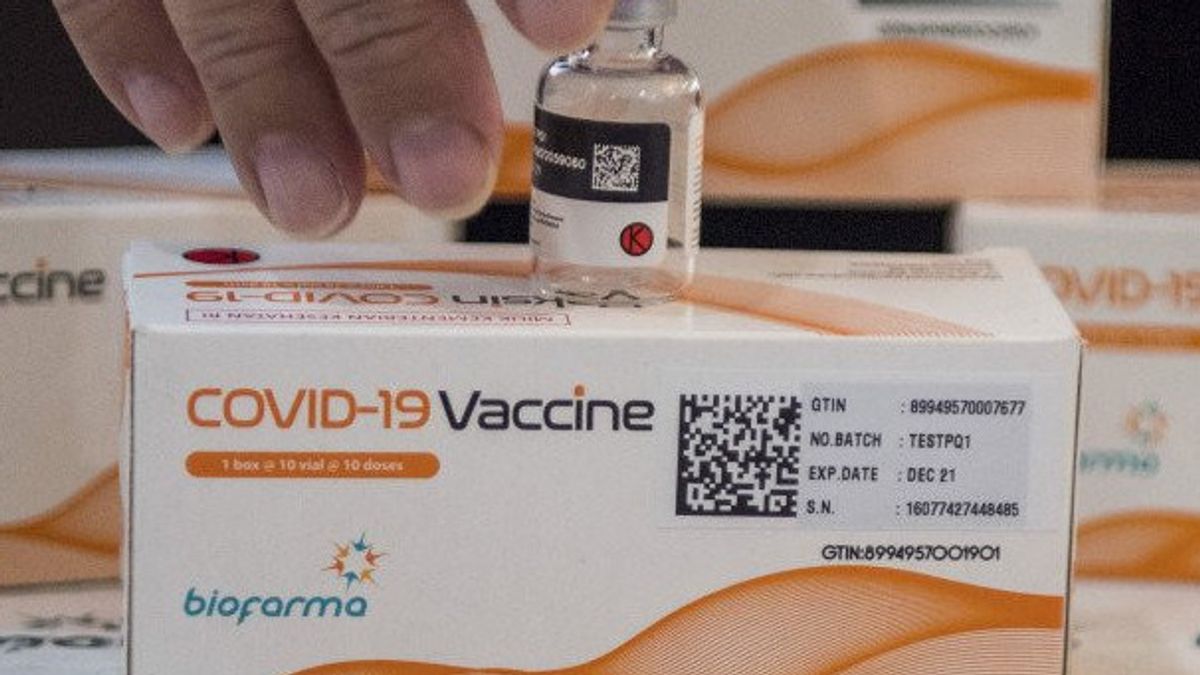
PT生物农场生产的疫苗采用来自S sinovac的原料,名为COVID-19疫苗。这种疫苗的包装与以前分发的疫苗不同,即CoronaVac。疫苗的 EUA 编号为 2102907543A1。
"我们感谢并感谢Bio Farma遵循时间表,以便今天能批准由Bio Farma生产的疫苗的欧盟A",她在2月16日星期二的虚拟新闻发布会上说。
Penny解释说,这种疫苗有5毫升小瓶供应,每瓶含有10剂疫苗,这是一种灭活病毒。这种疫苗每盒包装10瓶,因此在1盒有100剂。温度为 2 至 8 摄氏度。
此外,Penny说,每个疫苗瓶都装有一个二维条形码,其中包含疫苗的身份,因此不能伪造。
她说:"由于生产和包装地点不同,向这种疫苗提供欧盟A是分开的。
众所周知,PT Bio Farma(Persero)作为疫苗接种组织者,截至2021年2月11日,生产疫苗的一方已经提供了1300万份COVID-19疫苗。这1300万剂疫苗是该公司生产的13个批次中共有的。
疫苗接种过程在印度尼西亚各地分阶段进行,以减少COVID-19的传播。这是因为食品和药物管制署和政府继续优先考虑国家疫苗接种计划中使用的疫苗的质量和功效的安全方面。
The English, Chinese, Japanese, Arabic, and French versions are automatically generated by the AI. So there may still be inaccuracies in translating, please always see Indonesian as our main language. (system supported by DigitalSiber.id)












