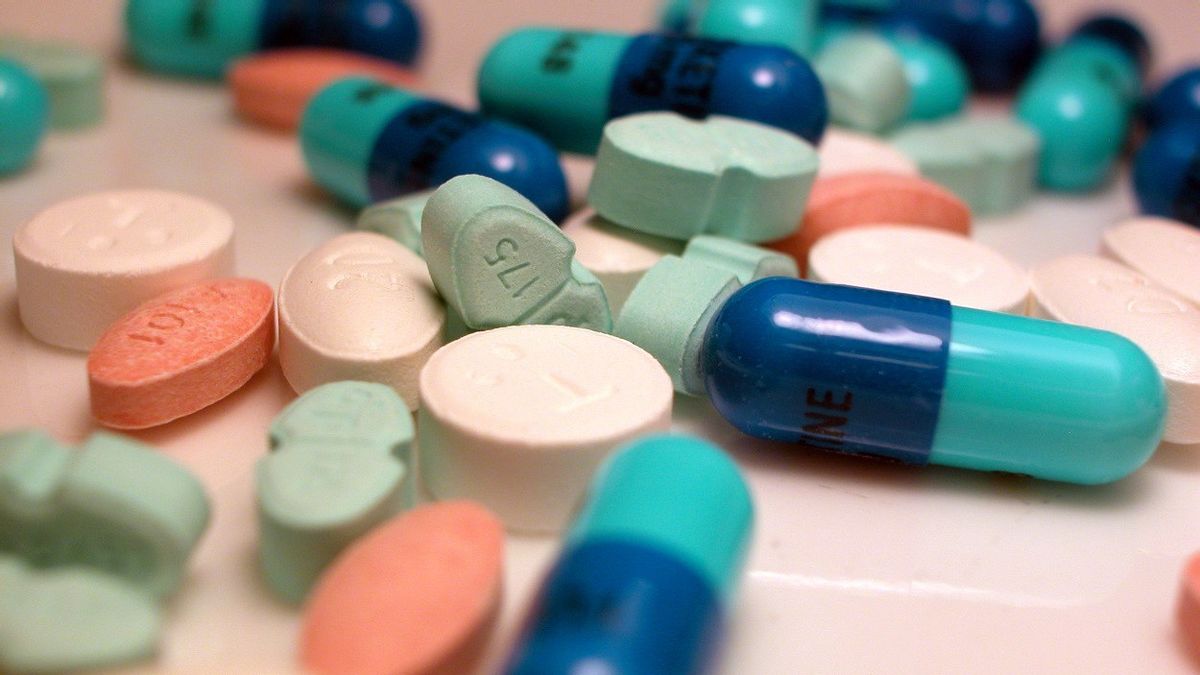
Jakarta - Les États-Unis ont approuvé mercredi la pilule antivirale COVID-19 de Pfizer, destinée aux personnes de 12 ans et plus à risque de maladie grave, en tant que premier traitement oral à domicile et nouvel outil pour lutter contre la variante à propagation rapide d’Omicron.
Le régime antiviral de Pfizer, Paxlovid, est efficace à près de 90% pour prévenir l’hospitalisation et la mort chez les patients à haut risque de maladie grave, selon les données des essais cliniques de la société. Des données de laboratoire récentes montrent que le médicament reste efficace contre Omicron, a déclaré Pfizer.
Pfizer a relevé ses prévisions de production pour 2022 de 80 millions à 120 millions de traitements, affirmant qu’il était prêt à commencer les livraisons bientôt aux États-Unis. Le régime à deux médicaments comprend un médicament plus récent et un deuxième antiviral plus ancien appelé ritonavir.
Le gouvernement américain aura 265 000 cours de traitement disponibles en janvier et les fournitures augmenteront dans les mois à venir, a déclaré Jeff Zients, coordinateur de la réponse à la COVID-19 de la Maison Blanche, lors d’un briefing. Le gouvernement s’attend à recevoir 10 millions de cours qui ont été commandés dans les six mois.
« L’approbation de Paxlovid est une étape importante marquant une nouvelle étape vers la transformation de la COVID-19 en une infection beaucoup plus gérable », a déclaré Amesh Adalja, chercheur principal à l’Institut Johns Hopkins pour la sécurité sanitaire.
« Cependant, deux problèmes majeurs demeurent: il sera rare dans les semaines à venir et son utilisation optimale nécessite un diagnostic rapide, ce qui peut être difficile avec les problèmes de tests constants qui nous affligent », a ajouté Adalja.
Par ailleurs, Pfizer dit avoir 180 000 cours de toilettage prêts à être expédiés cette année. Le contrat du gouvernement américain pour 10 millions de cours de médicaments est évalué à 530 dollars américains par cours.
La décision de la Food and Drug Administration (FDA) de délivrer des autorisations d’urgence pour ces traitements intervient alors que les États-Unis luttent contre une augmentation des cas de COVID-19 provoquée par la variante Omicron, le président Joe Biden annonçant des plans pour plus de vaccinations et de sites de test fédéraux.
La pilule pourrait combler une lacune de traitement ouverte par la variante Omicron, a déclaré William Schaffner, un expert en maladies infectieuses de premier plan à la faculté de médecine de l’Université Vanderbilt. Les traitements par anticorps monoclonaux les plus largement utilisés pour la COVID-19 se sont révélés moins efficaces dans la lutte contre la variante et il reste un nombre limité d’un traitement qui fonctionne, a-t-il déclaré.

Les anticorps monoclonaux sont généralement administrés par voie intraveineuse dans un hôpital, ne sont pas largement disponibles et coûtent plus de deux fois le prix des pilules Pfizer.
Pendant ce temps, la FDA a déclaré qu’elle autorisait Paxlovid pour une utilisation d’urgence pour le traitement de maladies légères à modérées chez les adultes et les enfants de 12 ans et plus, qui courent un risque élevé de développer une COVID-19 grave.
Ce médicament n’est disponible que sur ordonnance et devrait être commencé dès que possible après un diagnostic de COVID-19 et dans les cinq jours suivant l’apparition des symptômes, a déclaré la FDA. Les pilules sont destinées à être prises toutes les 12 heures pendant cinq jours.
Bien que l’essai clinique n’ait pas inclus de patients de moins de 18 ans, a déclaré Pfizer, un schéma posologique autorisé pour adultes devrait produire des concentrations sanguines comparables de médicaments chez les patients pédiatriques de 12 ans et plus pesant au moins 40 kg (88,2 lb).
Le deuxième médicament, le ritonavir, est connu pour interagir avec plusieurs autres médicaments sur ordonnance. Pfizer a déclaré que cela devrait être gérable et a suggéré que la plupart des patients seraient en mesure de réduire leurs doses d’autres médicaments tout en étant traités pour COVID-19.
Pfizer a déclaré qu’il prévoyait de déposer une demande de nouveau médicament auprès de la FDA en 2022 pour obtenir l’approbation réglementaire complète.
Il convient de noter que Pfizer a accepté de permettre aux fabricants de génériques de fournir des versions du médicament à 95 pays à revenu faible et intermédiaire dans le cadre d’un accord de licence avec le groupe international de santé publique Medicines Patent Pool (MPP).
Une pilule rivale de Merck & Co (MRK. N) est en cours d’examen par la FDA. Le médicament, le molnupiravir, qui a été développé avec Ridgeback Biotherapeutics, a réduit le risque d’hospitalisation et de décès de 30% dans l’essai.
The English, Chinese, Japanese, Arabic, and French versions are automatically generated by the AI. So there may still be inaccuracies in translating, please always see Indonesian as our main language. (system supported by DigitalSiber.id)